针对自贡二类医疗器械、自贡三类医疗器械有什么区别?如果申请需要什么条件?申请材料有哪些?启冠易立财税自贡部专业为您解答!
(一)二类、三类医疗器械有什么区别?
1、第二类具有中度风险,对其安全性、有效性应当加以控制的医疗器械。一般由省食品药品监督管理局来审批、发给注册证的,,注册号以2开头比如医用缝合针、血压计、体温计、心电图机、脑电图机、显微镜、针灸针、生化分析系统、助听器、超声消毒设备、不可吸收缝合线等。
2、第三类风险程度较高,植入人体,用于支持、维持生命;对人体具有潜在危险,对其安全性、有效性必须严格控制的医疗器械。一般由国家食品药品监督管理局来审批、发给注册证的,注册号以3开头。比如植入式心脏起搏器、角膜接触镜、人工晶体、超声肿瘤聚焦刀、血液透析装置、植入器材、血管支架、综合麻醉机、齿科植入材料、医用可吸收缝合线、血管内导管等。
(二)申请条件
1、具有与经营规模和经营范围相适应的质量进行管理研究机构或者专职质量安全管理会计人员。质量管理人员应具有国家认可的相关专业资格或专业职称;
2、具有与经营企业规模和经营活动范围相适应的相对独立的经营工作场所;
3、有与经营规模和范围相适应的仓储条件,包括符合医疗器械产品特性要求的仓储设施和设备。
4、应当通过建立一个健全企业产品服务质量进行管理会计制度,包括采购、进货验收、仓储保管、出库复核、质量跟踪制度和不良事件的报告制度等;
5、应当有适合其经营的医疗器械产品的技术培训和售后服务,或者同意提供第三方的技术支持。
(三)申请材料
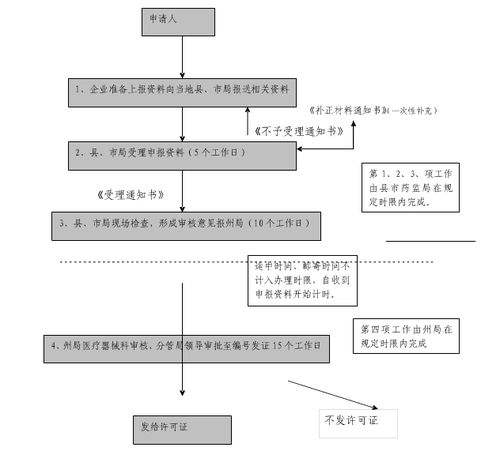
设立第二类、第三类医疗器械生产企业,应当向省、自治地方、直辖市食品药品监督管理部门申请领取生产许可证,生产许可证首先从中国食品药品监督管理局网站(http://www。51education. net).nmpa.gov.cn/)“网上办事”栏目中的“医疗器械生产经营许可备案信息系统”点击进入并按提示在网上提交以下资料后再打印书面资料(一式两份)到省政府政务服务中心食品药品监督管理局窗口现场申请:
1、企业工商营业执照复印件(验原件、收复印件);
2、组织机构代码证复印件;
3、所生产医疗器械的注册证;
4、产品技术要求复印件;
5、经营范围(经营品种目录)、经营方式说明
6、法定代表人(或投资人、执行事务合伙人)、企业负责人、质量负责人的进行身份证明复印件(验原件、收复印件);
7、生产、质量、技术负责人应具有3年以上医疗器械经营质量管理工作经历的证明或说明材料,从事体外诊断试剂质量管理人员应具有3年以上从事检验相关工作经历及无其他单位兼职情况的证明或说明材料(验原件、收复印件)
8、生产企业管理、质量进行检验工作岗位从业人员学历、职称一览表;
9、生产现场证明文件,包括房产证或租赁协议复印件、承租人房产证复印件、厂区总体平面图、主要生产车间平面布置图等。有洁净技术要求的车间,须标明功能间及人(物)流走向;有特殊企业生产生活环境设计要求的还应当提交设施、环境的证明文件复印件(洁净室的合格检测工作报告应是由省级食品药品质量监督成本管理会计部门认可的检测研究机构出具的一年内的符合《无菌医疗卫生器具生产经营管理制度规范》(YY0033)的合格检测分析报告);
10、主要内容生产技术设备和检验设备目录;
11、质量手册和程序文件,内容应符合我国医疗器械生产生活质量进行管理工作规范的规定;
12、程序流程图,列明主要控制项目及控制点,包括关键及特殊工序的设备、人员及工序参数的说明;
13、经办人授权委托书;
14、归档材料目录等其他资料。
启冠易立财税自贡部致力于高效、严谨、专业为您服务,如果还想了解更多详情,欢迎来电咨询400-600-2694.


 1
1





